Для української спільноти онкопацієнтів вже давно відома властивість канабісу полегшувати перебіг протокольного лікування онкології за допомогою хіміотерапії. Так, максимальне використання потенціалу конопель може збалансувати симптоми, зменшити страждання пацієнта для того, щоб він більш комфортно переносив лікування – менше нудоти, менше блювоти, більше апетиту, менше болю, більше якісного сну, кращий настрій.
Водночас вчені всього світу прискіпливо вивчають вплив канабіноїдів з рослини канабіс на самі клітини раку.
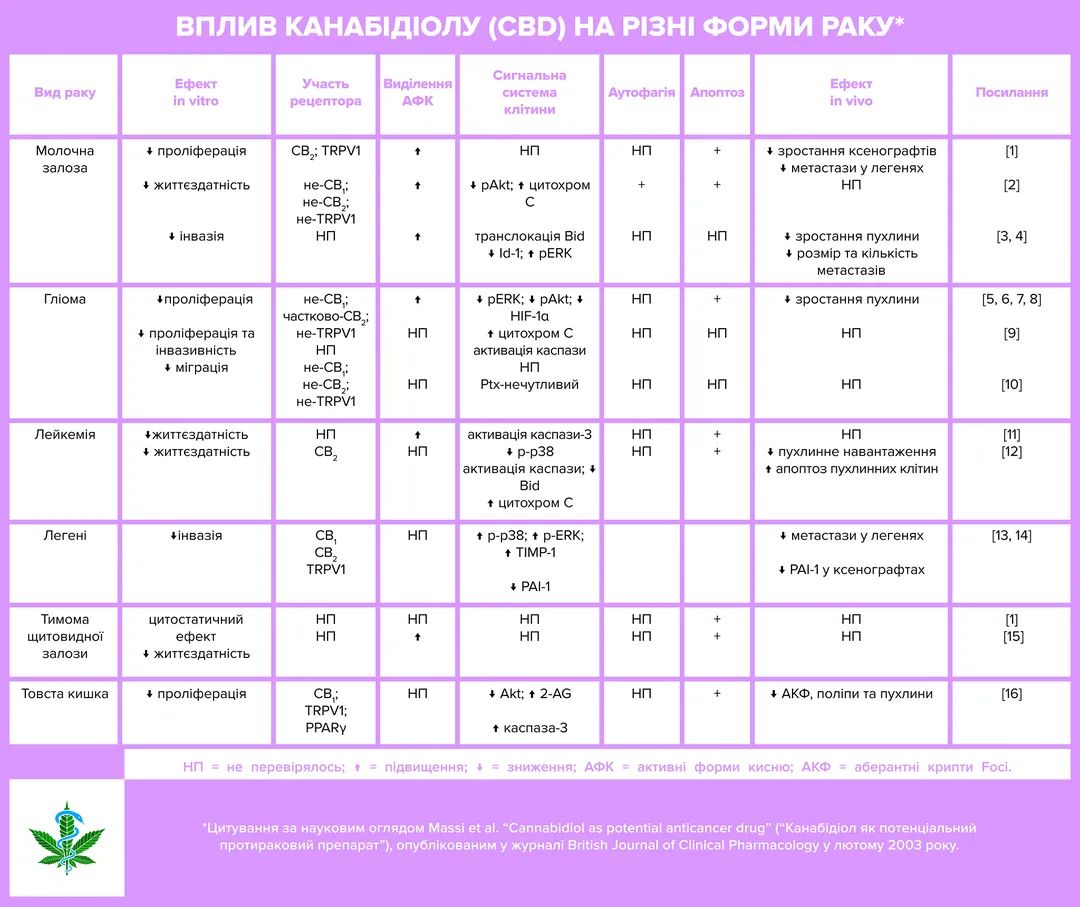
Сьогодні ми розглянемо наукову працю італійських науковців, які дослідили використання канабідіолу (CBD) у якості протиракового препарату. Ця робота була опублікована 5 років тому та виходить з того, що канабіноїди:
– мають виражений анти-проліферативний ефект (запобігають поділу та росту клітин раку);
– мають сильний про-апоптозний ефект (спричиняють “самогубство” клітин раку);
– відомі властивістю запобігати розростанню кровоносних судин у пухлинах;
– запобігають міграції ракових клітин, впливаючи на адгезію, інвазію та метастазування.
CBD не є психоактивностим та має скоріше низький рівень прикріплення до канабіноїдних рецепторів CB1 та CB2, діючи в основному через такі рецептори як TRPV, 5-HT1A, GPR55 та PPARy. Окрім своїх визначних терапевтичних властивостей по лікуванню болю та спастичності та інших патологій ЦНС, продемонстровано, що канабідіол має всі перелічені вище ефекти при взаємодії з онкологією.
У роботі детально проаналізовано властивості CBD щодо таких видів раку, як:
1) рак грудей;
2) гліома;
3) лейкемія/лімфома;
4) рак легенів;
5) ендокринні пухлини;
6) рак кишківника.
Ці властивості докладно викладено у Таблиці, яка ілюструє цей пост.
Що цікаво та вкрай важливо для лікування та самопочуття пацієнта, протираковий ефект канабідіолу поширюється селективно на ракові клітини, не впливаючі на нормальні клітини. Висока ефективність цього канабіноїду пов’язується з його властивістю цілити у множинні клітинні шляхи, які контролюють пухлинотворюючий процес через модулювання різного міжклітинного сигналювання, в залежності від виду раку. Найбільш поширений ефект канабідіолу – це зростання активних форм кисню (АФК/ROS),що вочевидь є вкрай важливим для запуску його цілющого впливу за всіх вказаних форм раку.
Варто відмітити, що канабідіол поводить себе як не-токсичний компонент (навіть високі дозування 700 мг/день протягом 6 тижнів не виявили шкідливого впливу на людину), що дозволяє призначати цей препарат для тривалого лікування.
Першоджерело:
Massi P. et al. “Cannabidiol as a potential anticancer drug”. British Journal of Clinical Pharmacology Volume 75, Issue 2
February 2013, http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2125.2012.04298.x/epdf
Наукові праці, на які посилається Таблиця:
[1] Bifulco M. et al. “ Endocannabinoids in endocrine and related tumours”. Endocrine-Related Cancer , 2008; 15, https://www.ncbi.nlm.nih.gov/m/pubmed/18508995/#fft
[2] Thomas A. et al. “Cannabidiol displays unexpectedly high potency as an antagonist of CB1 and CB2 receptor agonists in vitro”. British Journal of Pharmacology, 2007; 150. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2189767/
[3] Freimuth N. et al. “Antitumorigenic effects of cannabinoids beyond apoptosis”. Journal of Pharmacology and Experimental Therapeutics, 2010; 332. https://www.ncbi.nlm.nih.gov/pubmed/19889794
[4] Pertwee R.G. et al “(-)-Cannabidiol antagonizes cannabinoid receptor agonists and noradrenaline in the mouse vas deferens”. European Journal of Pharmacology, 2002; 456. https://www.ncbi.nlm.nih.gov/m/pubmed/12450575
[5] McAllister S.D et al. “Pathways mediating the effects of cannabidiol on the reduction of breast cancer cell proliferation, invasion, and metastasis”. Breast Cancer Research and Treatment 2011; 129. https://www.ncbi.nlm.nih.gov/pubmed/20859676
[6] Shrivastava A. et al. “Cannabidiol induces programmed cell death in breast cancer cells by coordinating the cross-talk between apoptosis and autophagy”. Molecular Cancer Therapeutics, 2011; 10. https://www.ncbi.nlm.nih.gov/pubmed/21566064
[7] Jacobsson S.O. et al. ‘Serum-dependent effects of tamoxifen and cannabinoids upon C6 glioma cell viability”. Biochemical Pharmacology 2000; 60. https://www.ncbi.nlm.nih.gov/pubmed/11108795
[8] Massi P. et al.” Antitumor effects of cannabidiol, a nonpsychoactive cannabinoid, on human glioma cell lines”. Journal of Pharmacology and Experimental Therapeutics ,2004; 308. https://www.ncbi.nlm.nih.gov/pubmed/14617682
[9] Cho D.H. et al. “Caspase-mediated cleavage of ATG6/Beclin-1 links apoptosis to autophagy in HeLa cells”. Cancer Lett ers, 2009; 274. https://www.ncbi.nlm.nih.gov/pubmed/18842334
[10] Massi P. et al. “The non-psychoactive cannabidiol triggers caspase activation and oxidative stress in human glioma cells”. Cellular and Molecular Life Sciences , 2006; 63. https://www.ncbi.nlm.nih.gov/pubmed/16909207
[11] Marcu J.P. et al.” Cannabidiol enhances the inhibitory effects of delta9-tetrahydrocannabinol on human glioblastoma cell proliferation and survival”. Molecular Cancer Therapeutics , 2010; 9. https://www.ncbi.nlm.nih.gov/pubmed/20053780
[12] Torres S. et al. “A combined preclinical therapy of cannabinoids and temozolomide against glioma”. Molecular Cancer Therapeutics , 2011; 10. https://www.ncbi.nlm.nih.gov/pubmed/21220494
[13] McKallip R.J et al. ‘Targeting CB2 cannabinoid receptors as a novel therapy to treat malignant lymphoblastic disease”. Blood 2002; 100. https://www.ncbi.nlm.nih.gov/pubmed/12091357
[14] Li R. et al.”Identification of putative oncogenes in lung adenocarcinoma by a comprehensive functional genomic approach”. Oncogene 2006; 25. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5034240/
[15] Molina J.R. et al. “Advances in chemotherapy of non-small cell lung cancer”. Chest 2006; 130: 1211–9. journal.chestnet.org/article/S0012-3692(15)51160…/fulltext
[16] Ramer R. et al. “ Decrease of plasminogen activator inhibitor-1 may contribute to the anti-invasive action of cannabidiol on human lung cancer cells”. Pharmaceutical Research, 2010; 27. https://www.ncbi.nlm.nih.gov/m/pubmed/20668920